Viz příbalová informace pro přípravek Cilest (Ethinylestradiolum, Norgestimatum). Zkontrolujte složení, použití, dávkování a popis přípravku. SLOŽENÍ, POPIS ČINNOSTI, INDIKACE, KONTRAINDIKACE, DOPORUČENÁ BEZPEČNOSTNÍ OPATŘENÍ, INTERAKCE S JINÝMI LÉČIVAMI, DÁVKOVÁNÍ A ZPŮSOB PODÁNÍ, NEŽÁDOUCÍ ÚČINKY.
Cilest LEAFLET
výrobce: Janssen-Cilag International N.V.
prášky
Léčivé látky: Ethinylestradiol, Norgestimate
ATC kód: G 03 A A 11
Synonyma:
Ethinylestradiol Aethinyloestradiolum; Ethinylestradiol; Éthinylestradiol; Ethinylestradiol; Ethinylestradiol; Etinilestradiol; Etinilestradiolis; Etinilstradiol; Etinilösztradiol; Ethinylestradiol; Etinyyliestradioli; Ethinylestradiol Norgestimate Dexnorgestrel Acetime; Norgestimaatti; Norgestimate; Norgestimato; Norgestimatum
Indikace: antikoncepce
VAROVÁNÍ! Příbalová informace pro pacienta je součástí balení léčivého přípravku. Obsahuje informace pro pacienta o správném užívání drogy.
Cilest®
prášky
Složení
Jedna tableta obsahuje:
0,250 mg norgestimatum
0,035 mg ethinylestradiolu
Pomocné látky:
Bezvodá laktóza, modifikovaný škrob, stearát hořečnatý, hlinitý lak indigokarmínu.
Popis akce
Cilest® inhibuje sekreci gonadotropinů v důsledku estrogenních a progestagenních účinků ethinylestradiolu a norgestimátu. Primárním mechanismem účinku je inhibice ovulace. Ke kontracepčnímu účinku může přispět také změna vlastností cervikálního hlenu a endometria.
Další činnosti nesouvisející s prevencí těhotenství.
Účinky na menstruaci: zvýšit pravidelnost menstruačního cyklu, snížit ztráty krve a snížit výskyt anémie z nedostatku železa, snížit výskyt dysmenorey.
Účinky související s inhibicí ovulace: snížení výskytu funkčních ovariálních cyst, snížení výskytu mimoděložních těhotenství.
Další aktivity: snížení výskytu fibroadenomů, mastopatie, snížení výskytu akutních zánětlivých onemocnění pánve, snížení výskytu rakoviny endometria, snížení výskytu rakoviny vaječníků.
Indikace
Perorální antikoncepce.
Kontraindikace
- Tromboflebitida nebo jiné tromboembolické poruchy
- Předchozí tromboflebitida hlubokých žil nebo jiné tromboembolické poruchy
- Poruchy mozkové cirkulace nebo ischemické choroby srdeční
- Migréna s fokální aurou
- Známá rakovina prsu nebo podezření na ni
- Komplikované srdeční onemocnění
- Těžká hypertenze (konstantní systolický krevní tlak rovný nebo větší než 160 mm Hg a diastolický krevní tlak rovný nebo vyšší než 100 mm Hg)
- Diabetes mellitus s cévními komplikacemi
- Rakovina endometria nebo jiný známý nebo suspektní novotvar závislý na estrogenu
- Nediagnostikované abnormální vaginální krvácení
- Žloutenka v důsledku cholestázy (cholestatická) v těhotenství nebo žloutenka s anamnézou užívání orální antikoncepce.
- Akutní nebo chronické onemocnění jaterních buněk se zhoršenou funkcí jater
- Adenom nebo rakovina jater
- Těhotenství nebo předpoklad těhotenství
- Historie těhotného oparu (diagnóza potvrzena kožní biopsií)
- Přecitlivělost na kteroukoli složku přípravku
Zvláštní upozornění a doporučená opatření
Při stanovení poměru rizika a prospěšnosti užívání perorálních kontraceptiv je třeba zkontrolovat, zda existuje některý z níže uvedených stavů, které mohou zvyšovat riziko komplikací spojených s užíváním perorálních kontraceptiv:
- Poruchy, které mohou zvýšit riziko vzniku žilních tromboembolických komplikací, jako je prodloužená imobilizace nebo větší chirurgický zákrok
- Rizikové faktory pro arteriální onemocnění, např. Kouření, zvýšené lipidy v séru (hyperlipidemie), vysoký krevní tlak nebo obezita
- Hypertenze (konstantní systolický krevní tlak mezi 140 a 159 mm Hg a diastolický krevní tlak mezi 90 a 99 mm Hg)
- Cukrovka
- Těžká deprese nebo těžká deprese v anamnéze
- Kouření tabáku
Všeobecné
Perorální antikoncepce nechrání před infekcí virem lidské imunodeficience (HIV) nebo jinými pohlavně přenosnými chorobami.
Před předepsáním perorální antikoncepce by měla být provedena úplná anamnéza a fyzikální vyšetření. Lékařské prohlídky by měly být pravidelně opakovány v souladu s obecně platnými pravidly.
Doporučuje se kontrolovat léky užívané ženou, která se prezentuje, na předpis orální antikoncepce. To platí také pro rostlinné přípravky (zejména třezalka tečkovaná Hypericum perforatum). Přečtěte si příbalové informace o všech lécích užívaných spolu s perorálními kontraceptivy (viz Interakce s jinými léky).
V případě nediagnostikovaného, přetrvávajícího nebo opakovaného vaginálního krvácení je třeba provést příslušné testy, aby se vyloučila přítomnost maligního nádoru.
Perorální antikoncepci lze použít nejdříve tři měsíce poté, co se parametry jaterních funkcí vrátily do normálu po hepatitidě. U těžké hepatitidy nesmí být toto období kratší než šest měsíců.
Tromboembolické poruchy a jiné vaskulární poruchy
Existují důkazy o zvýšeném riziku tromboembolických poruch a trombotických poruch spojených s užíváním perorálních kontraceptiv. Relativní riziko u žen užívajících perorální antikoncepci je vyšší ve srovnání s relativním rizikem u žen neužívajících perorální antikoncepci: 3krát vyšší výskyt povrchové žilní trombózy poprvé, 4 až 11násobný výskyt hluboké žilní trombózy nebo plicní embolie a 1,5 až 6krát u žen s faktory predisponujícími k rozvoji žilní tromboembolie. Riziko tromboembolismu spojené s užíváním perorálních kontraceptiv nezávisí na délce jejich užívání a zmizí po ukončení užívání přípravků.
U žen užívajících perorální antikoncepci došlo po operaci k 2 až 4násobnému zvýšení relativního rizika tromboembolických komplikací. Relativní riziko vzniku žilní trombózy je dvakrát vyšší u žen s predisponujícími faktory pro jejich vývoj ve srovnání se ženami bez těchto faktorů.
Pokud je to možné, v případě plánovaného chirurgického zákroku s rizikem tromboembolie by mělo být užívání perorálních kontraceptiv přerušeno nejméně na čtyři týdny před a dva týdny po operaci a po delší dobu pooperační imobility. Navíc v období bezprostředně po porodu existuje zvýšené riziko vzniku tromboembolických poruch, proto by u žen, které neplánují kojit, měla být perorální antikoncepce užívána nejdříve 3 týdny po porodu. Po potratu po 20 týdnech těhotenství nebo po něm lze perorální antikoncepci použít 21 dní po potratu nebo první den prvního spontánního menstruačního krvácení, podle toho, co nastane dříve.
Relativní riziko vzniku arteriální trombózy (např. Cévní mozková příhoda, infarkt myokardu) je vyšší v přítomnosti predisponujících faktorů, jako je kouření, vysoký krevní tlak, zvýšené hladiny lipidů v séru (hyperlipidémie), obezita, cukrovka, preeklampsie v anamnéze a vyšší věk . Tyto závažné vaskulární komplikace se vyskytly při užívání perorálních kontraceptiv obsahujících 50 mikrogramů nebo více estrogenu. Riziko vaskulárních poruch může být nižší při nižších dávkách perorálních kontraceptiv obsahujících estrogeny a progestogeny.
Riziko závažných nežádoucích účinků z kardiovaskulárního systému se zvyšuje s věkem a se silným kouřením. Riziko je významné u žen starších 35 let, které kouří. Ženám užívajícím perorální antikoncepci je třeba doporučit přestat kouřit.
U žen užívajících perorální antikoncepci byl hlášen zvýšený krevní tlak. Zvýšení krevního tlaku je častější u starších žen a u uživatelů dlouhodobé antikoncepce. U mnoha žen došlo po vysazení perorální antikoncepce k obnovení normálního krevního tlaku. Mezi skupinou žen, které v minulosti používaly perorální antikoncepci, a skupinou žen, které nikdy neužívaly perorální antikoncepci, nebyl žádný rozdíl ve výskytu hypertenze.
U žen s arteriální hypertenzí (systolický krevní tlak 140 až 159 mm Hg / diastolický krevní tlak 90 až 99 mm Hg) snižte na normální hladinu a upravte krevní tlak před zahájením užívání perorálních kontraceptiv. V případě významného zvýšení krevního tlaku je třeba vysadit perorální antikoncepci.
Při užívání perorálních kontraceptiv byla hlášena trombóza sítnice. Perorální antikoncepce by měla být vysazena v případě nevysvětlitelné přechodné částečné nebo úplné ztráty zraku, rozmazaného nebo dvojitého vidění, makulárního edému nebo vaskulárních změn sítnice. V takových situacích by měla být příčina poruch diagnostikována okamžitě a měla by být zahájena vhodná léčba.
Nádory jater
Výskyt benigních a maligních jaterních nádorů (jaterní adenomy a hepatocelulární karcinomy) je nízký. Riziko těchto nádorů se může zvyšovat s dobou a délkou užívání perorálních kontraceptiv. Ruptura jaterních adenomů může být fatální v důsledku nitrobřišního krvácení.
Rakovina reprodukčních orgánů a prsu
Ženy, které v současné době užívají orální antikoncepci nebo ji užívaly za posledních 10 let, mají o něco vyšší riziko diagnostikování rakoviny prsu, ale pokud je diagnostikována, obvykle se omezuje na prsní žlázu. Věk, ve kterém žena přestane užívat perorální antikoncepci, je důležitým rizikovým faktorem pro vznik rakoviny prsu. Čím vyšší je věk při vysazení OC, tím větší je pravděpodobnost diagnózy rakoviny prsu. Délka užívání orální antikoncepce měla v tomto ohledu menší význam.
Žena by měla zvážit možnost zvýšení rizika vzniku rakoviny prsu ve vztahu k výhodám užívání perorálních kontraceptiv.
Vliv na metabolismus
Perorální antikoncepce může způsobit sníženou glukózovou toleranci. Tento účinek přímo souvisí s dávkou estrogenu. Steroidní ženské pohlavní hormony produkované a vylučované žlutým tělem vaječníku v luteální fázi (progestogeny) mohou zvýšit sekreci inzulínu a způsobit rezistenci tkáně na inzulin, jejíž závažnost závisí na typu použitého progestogenu. U zdravých (nediabetických) žen nemá perorální antikoncepce žádný vliv na hladinu glukózy v séru nalačno. Vzhledem k účinkům perorálních kontraceptiv by měly být ženy s prediabetem nebo diabetem, které užívají perorální antikoncepci, pečlivě sledovány.
U malého procenta žen užívajících perorální antikoncepci dochází k trvalému zvýšení triglyceridů v séru (hypertriglyceridemie).
Bolest hlavy
Poprvé nebo zhoršení migrény nebo neobvyklé, opakující se, přetrvávající nebo silné bolesti hlavy by mělo být užívání COC přerušeno a měla by být vyšetřena příčina bolesti hlavy.
Nepravidelné krvácení
U žen užívajících perorální antikoncepci se může objevit krvácení z průniku, špinění a / nebo absence krvácení, zejména během prvních tří měsíců užívání. Zjistěte, zda existuje jiná příčina těchto poruch, a je-li to nutné, proveďte další testy k vyloučení rakoviny nebo těhotenství.
U některých žen se po ukončení užívání perorální antikoncepce může objevit amenorea nebo nepravidelná menstruace, zvláště pokud k poruše došlo před zahájením užívání perorální antikoncepce.
Skvrnité zabarvení kůže, většinou na obličeji (chloasma)
Chloasma se může vzácně vyskytnout u žen užívajících perorální antikoncepci, zejména u žen, které měly chloasma gravidarum. Ženy se sklonem k chloasmě by se během užívání přípravku měly vyvarovat vystavení slunci nebo ultrafialovému záření. Chloasma často po vysazení přípravku úplně nevymizí.
Používejte během těhotenství a kojení
Cilest® by se neměl užívat během těhotenství.
Vliv na schopnost řídit motorová vozidla, provoz strojů a psychofyzikální účinnost
Přípravek Cilest® nemá žádný vliv na schopnost řídit vozidla a obsluhovat pohyblivé mechanismy.
Interakce s jinými léky (interakce).
Různé léky a bylinné přípravky, včetně třezalky tečkované, mohou ovlivnit metabolismus perorálních kontraceptiv. Účinnost přípravku je významně snížena faktory, které zvyšují metabolismus a vylučování účinných látek. Patří mezi ně faktory, které stimulují enzymy metabolizující estrogen, a faktory, které ovlivňují enterohepatální cirkulaci estrogenů. Snížená účinnost estrogenové složky perorální antikoncepce může způsobit špinění, intermenstruační krvácení nebo selhání antikoncepce. Je možné, že stimulace stejných izoenzymů může také vést ke snížení koncentrace progestogenové složky přípravku Cilest® v krvi. Léky a rostlinné přípravky, o nichž je známo, že mají stimulační účinek na enzymy odpovědné za rozklad steroidních hormonů v perorálních kontraceptivách (např. Třezalka tečkovaná, barbituráty, sodná sůl fenytoinu a zejména rifampicin), mají klinický význam. Některé inhibitory proteázy a některá antiretrovirová léčiva zvyšují (např. Indinavir) nebo snižují (např. Ritonavir) hladiny léčivých látek kombinované hormonální antikoncepce (např. Ritonavir).
Dalším typem interakce je narušení enterohepatální cirkulace estrogenů, které může vést ke zrychlenému vylučování účinných látek a ke snížení účinnosti perorálních kontraceptiv. Taková interakce je pozorována například při kombinaci léčiva (např. Cholestyraminu) s konjugáty žlučových estrogenů nebo při zhoršené degradaci konjugátů střevními bakteriemi (např. Po užití určitých antibiotik - ampicilinu nebo tetracyklinu).
Bylo zjištěno snížení účinnosti antikoncepčního účinku při současném užívání přípravků Cilest® a rifampicinu i přípravků z třezalky tečkované. Byly hlášeny interakce s topiramátem, barbituráty, fenylbutazonem, fenytoinem sodným, karbamazepinem. Možné jsou interakce s griseofulvinem, ampicilinem, (troglitazonem) a tetracykliny.
Vliv přípravku Cilest® na výsledky laboratorních testů
Perorální antikoncepce může interferovat s některými testy endokrinních a jaterních funkčních testů a krevními testy:
- zvýšení koncentrace protrombinu a faktorů II, VII, VIII, IX, X, XII a XIII; pokles koncentrace antitrombinu 3; zvýšení agregace trombocytů vyvolané noradrenalinem.
- Zvýšení globulinu vázajícího hormony štítné žlázy (TBG), které vede ke zvýšení celkových hladin hormonů štítné žlázy v krvi, měřeno jako jód vázaný na bílkoviny (PBI), a tyroxinu, měřeno sloupcovou chromatografií nebo radioimunotestem. Snížení absorpce volné trijodtyroninové pryskyřice odpovídající zvýšení TBG. Koncentrace volného tyroxinu zůstává nezměněna.
- Může dojít ke zvýšení koncentrace jiných proteinů vázajících sérum.
- Zvýšení globulinu vázajícího pohlavní hormony, což vede ke zvýšení celkové hladiny pohlavních hormonů v krvi. Nicméně koncentrace volných, tj. Biologicky aktivních hormonů, buď klesají, nebo zůstávají nezměněny.
- Může dojít ke zvýšení cholesterolu s vysokou hustotou lipoproteinů (HDL) a celkového cholesterolu. Může dojít ke zvýšení nebo snížení hladiny cholesterolu s nízkou hustotou lipoproteinů (LDL) se snížením poměru LDL-C / HDL-C a nezměněnými triglyceridy. Uvedené účinky závisí na dávkách estrogenu a progestogenu a typu progestogenu.
- Může dojít ke zhoršení tolerance glukózy.
- Během užívání perorálních kontraceptiv může dojít ke snížení hladiny kyseliny listové v séru. To může mít klinický význam, pokud žena otěhotní brzy po ukončení užívání perorálních kontraceptiv.
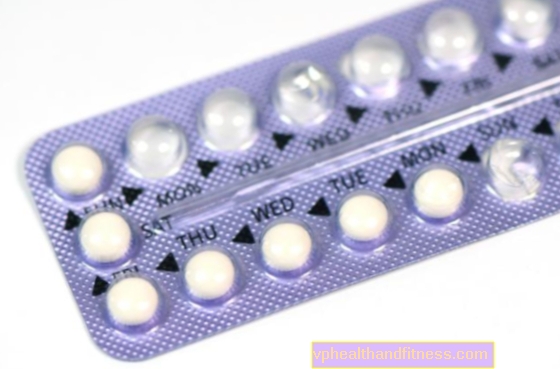
Dávkování a způsob podání
Účinnost perorálních antikoncepčních přípravků
Pokud se použije přesně podle pokynů, aniž by se zapomnělo na tablety, je pravděpodobnost otěhotnění menší než 1% (tj. Méně než 1 těhotenství u 100 žen užívajících přípravek po dobu jednoho roku). Průměrná míra selhání je během prvního roku používání 5%. Pravděpodobnost otěhotnění se zvyšuje s každou vynechanou tabletou v daném cyklu.
Použití u dospělých
Aby se dosáhlo maximální antikoncepční účinnosti, měly by se tablety Cilest® užívat přesně tak, jak je předepsáno, a ve správném pořadí, každý den ve stejnou dobu, například před spaním. Užívejte tablety každý den bez přestávky následujícím způsobem: Užívejte jednu tabletu jednou denně s vodou ve stejnou denní dobu po dobu 21 dnů. Po užití poslední tablety byste neměli užívat žádné tablety po dobu 7 dnů. Pokud svůj lék neužíváte, můžete očekávat určité krvácení, obvykle 2 až 4 dny po užití poslední tablety. Na konci tohoto 7denního období by měl být zahájen nový cyklus užívání tablet Cilest®, i když krvácení nezačalo nebo ještě neskončilo.
V prvním cyklu užívání by dávkování mělo začít první den menstruačního krvácení (jak je popsáno výše). Lék by měl být užíván s vodou ve stejnou denní dobu po dobu 21 dnů. Pokud je přípravek Cilest® užíván podle doporučení, má antikoncepční účinek od prvního dne užívání a po dobu 7 dnů od neužívání tablet (mezi po sobě jdoucími baleními přípravku).
Děti
Bezpečnost a účinnost přípravku Cilest® byla stanovena u žen v plodném věku. Lék by se neměl používat u dívek před nástupem menstruace.
Staří lidé
Nedoporučuje se užívat ženám v postmenopauzálním období.
Zahájení užívání přípravku Cilest® u žen, které dříve užívaly jinou kombinovanou perorální antikoncepci (estrogen-progestogen).
Při přechodu z jiné kombinované perorální antikoncepce by mělo být užívání přípravku Cilest® zahájeno do 1 až 7 dnů od užití poslední tablety antikoncepčního přípravku použitého v předchozím cyklu. Interval mezi užitím poslední tablety dříve použitého přípravku a užitím první tablety přípravku Cilest® by neměl být delší než 7 dní. V případě, že mezi užitím poslední antikoncepční tablety v předchozím cyklu a první tabletou přípravku Cilest® dojde k více než 7denní přestávce, je nutné použít účinnou doplňkovou nehormonální metodu antikoncepce. Mělo by se používat po dobu jednoho týdne, tj. Do doby, než užijete sedm tablet přípravku Cilest®.
Zahájení užívání přípravku Cilest® u žen, které dříve užívaly jinou perorální antikoncepci (pouze progestin).
Při přechodu z antikoncepce obsahující pouze progestagen by měla být léčba přípravkem Cilest® zahájena první den po užití poslední tablety dříve použitého přípravku. Během prvních 7 dnů by měla být použita další nehormonální metoda antikoncepce.
Použití přípravku Cilest® po porodu
Ženy, které se rozhodly nekojit, mohou začít používat perorální antikoncepci, včetně přípravku Cilest®, nejdříve 3 týdny po porodu (viz Tromboembolické a jiné vaskulární poruchy a Těhotenství a kojení). Pokud se rozhodnete začít užívat přípravek Cilest® později než 21 dní po porodu, může váš lékař rozhodnout, zda je nutné během prvních 7 dnů používat spolu s přípravkem Cilest® další nehormonální metodu antikoncepce, nebo zda byste s podáváním přípravku Cilest® měli počkat až do nástupu první menstruační krvácení.
Použijte po potratu
Po potratu před 20. týdnem těhotenství lze okamžitě zahájit užívání perorálních kontraceptiv. Není nutné používat další metodu antikoncepce.
Po potratu ve 20. týdnu těhotenství nebo později lze zahájit užívání hormonální antikoncepce 21. den po potratu nebo první den prvního spontánního menstruačního krvácení, podle toho, co nastane dříve. Během prvních 7 dnů prvního cyklu by měla být současně použita nehormonální metoda antikoncepce. Ve výjimečných případech, kdy existují náznaky zahájení účinné metody antikoncepce bezprostředně po potratu, by měla být léčba přípravkem Cilest® zahájena během prvního týdne po potratu. Je třeba vzít v úvahu zvýšené riziko tromboembolických poruch v období bezprostředně po potratu.
Postup v případě, že jste tablety neužívali včas
Pokud zapomenete užít tabletu včas (ne více než 24 hodin mezi užitím každé tablety), užijte vynechanou tabletu, jakmile si vzpomenete. Vezměte si další tabletu v plánovaném čase. To znamená, že v jeden den lze užít dvě tablety.
Pokud dojde k vynechání dvou tablet během prvního nebo druhého týdne cyklu, je třeba užít dvě tablety v den, kdy si pamatujete připomenutí, a dvě tablety se mají užít následující den. Poté užijte jednu tabletu denně podle doporučení, dokud nebudou použity všechny tablety v balení. Kromě toho by se měla každý den používat další účinná nehormonální metoda antikoncepce, dokud se nepřijme sedmá tableta po sobě.
Pokud jste vynechal dvě tablety ve třetím týdnu užívání přípravku, užijte další tablety z tohoto balení, zahoďte je a začněte užívat tablety z dalšího balení ve stejný den. Kromě toho by se měla každý den používat další účinná nehormonální metoda antikoncepce, dokud se nepřijme sedmá tableta po sobě.
Pokud jste během prvních tří týdnů po užití přípravku neužívali tři tablety, užijte další tablety z tohoto balení, vyhoďte je a začněte užívat tablety z dalšího balení ve stejný den. Kromě toho je třeba každý den používat další účinnou nehormonální metodu antikoncepce, dokud nedojde k požití sedmé tablety.
Průlomové krvácení nebo špinění
V případě průlomového krvácení nebo špinění je třeba pokračovat v antikoncepci. Krvácení z průniku je pravděpodobnější při použití produktů s nízkým obsahem estrogenu (ovulace). Tento typ krvácení se často zastaví po několika cyklech. V případě přetrvávajícího intermenstruačního krvácení se poraďte s gynekologem.
V případě, že během období bez užívání tablet nedojde ke krvácení (tzv. Krvácení z vysazení), je třeba v antikoncepčních pilulkách pokračovat. Pokud byla perorální antikoncepce užívána správně, absence krvácení během období bez užívání tablet nemusí nutně znamenat těhotenství. Nicméně těhotenství musí být vyloučeno.
Pokyny v případě zvracení
Pokud dojde ke zvracení do 3 hodin po užití tablety nebo pokud silný průjem přetrvává déle než 24 hodin, může být antikoncepční účinnost přípravku snížena. Pokud zvracení nebo průjem rychle ustanou, bude účinná antikoncepce zachována, dokud se ve stejný den užije druhá tableta přípravku Cilest®. V případě zvracení nebo průjmu po dobu 24 hodin nebo déle může být antikoncepční účinek snížen a do dne užívání sedmi tablet po sobě (denně) by měla být použita další nehormonální metoda antikoncepce.
Předávkování
Život ohrožující příznaky v důsledku předávkování perorálními antikoncepčními prostředky nebyly popsány. Předávkování může způsobit nevolnost a zvracení au dívek vaginální krvácení. Neexistují žádná antidota a léčba by měla být symptomatická.
Vedlejší efekty
Při užívání perorálních kontraceptiv byly hlášeny následující nežádoucí účinky (viz Zvláštní upozornění a opatření pro použití).
- Kardiovaskulární systém: hypertenze, infarkt myokardu, poruchy cerebrálního oběhu, hluboká žilní trombóza, arteriální tromboembolismus, plicní embolie a další blokády.
- Nádory: benigní jaterní nádory, maligní jaterní nádory, rakovina děložního čípku, rakovina prsu.
- Játra a žlučové cesty: intrahepatální cholestáza (cholestáza), žlučové kameny.
- Různé: silné bolesti hlavy, migréna, poškození optického nervu.
Další nežádoucí účinky
- Kardiovaskulární systém: mírné zvýšení krevního tlaku, otoky.
- Reprodukční systém: průlomové krvácení, špinění, amenorea, žádné krvácení z vysazení, změny v menstruačním krvácení, zvýšená velikost děložních myomů, vaginální kandidóza, zvýšená eroze děložního čípku a sekrece krční žlázy.
- Prsa: citlivost, galaktorea, bolest, zvětšení, snížení sekrece mléka při použití ihned po porodu.
- Trávicí trakt: nevolnost, zvracení, křeče v břiše, plyn, kolitida. Kůže: erythema nodosum, vyrážka, chloasma, erythema multiforme, akné, seborea, alopecie, hirsutismus (hirsutismus, hypertrichóza), pemfigoid (gestační herpes), změna barvy, která nemusí vymizet po vysazení, hemoragické erupce.
- Játra a žlučové cesty: žloutenka způsobená cholestázou (cholestatická), Budd-Chiariho syndrom.
- Oči: změna zakřivení rohovky (macerace), nesnášenlivost kontaktních čoček, katarakta. Centrální nervový systém: bolest hlavy, změny nálady, deprese, podrážděnost, chorea. Metabolické poruchy: zadržování tekutin, změny hmotnosti (zvýšení nebo snížení), porucha glukózové tolerance, změny chuti k jídlu.
- Jiné: změny pohlavního styku (libido), premenstruační syndrom, dočasná neplodnost, přechodné po vysazení přípravku.
- Močový systém: renální dysfunkce, hemolyticko-uremický syndrom.
Informujte svého lékaře o výskytu těchto nebo jiných nežádoucích účinků.
Přípravek nepoužívejte po uplynutí doby použitelnosti
Způsob skladování
Uchovávejte v původním obalu.
Uchovávejte při teplotě do 25 ° C.
Udržujte mimo dosah dětí.
Dostupné balíčky
Přímé balení
Blistr obsahující 21 tablet
Kolektivní balení
Blistry jsou baleny v kartonových krabicích.
Jedna krabička obsahuje 1 nebo 3 blistry tablet Cilest®.
Odpovědný subjekt
Janssen - Cilag International NV
Turnhoutseweg 30
B - 2340 Beerse
Belgie
Výrobce, se kterým je šarže léčivého přípravku uvolněna
Janssen Pharmaceutica NV
Turnhoutseweg 30
B - 2340 Beerse
Belgie
Podrobnější informace získáte u zástupce držitele rozhodnutí o registraci:
Janssen-Cilag Polska Sp. z o.o.
ul. Iłżecka 24
02-135 Varšava
Datum této příbalové informace: 3. října 2007
VAROVÁNÍ! Příbalová informace pro pacienta je součástí balení léčivého přípravku. Obsahuje informace pro pacienta o správném užívání drogy.