Díky svým vlastnostem byl hliník široce používán. Používá se k výrobě hrnců, víček, podnosů, plechovek a fólií, které přicházejí do styku s potravinami. Je vaření v hliníkových nádobách, pečení v hliníkové fólii nebo grilování v hliníkových plechech zdraví škodlivé? Zkontrolujte účinky hliníku na zdraví.
Obsah
- Hliník - vlastnosti a použití
- Hliník - dopad na zdraví. Je hliník škodlivý?
- Hliník - zdroje v potravinách a další
- Hliník - potravinářské přídatné látky obsahující hliník
- Jsou hliníkové hrnce škodlivé? Je hliníková fólie zdravá?
Hliník, nebo spíše hliník, je chemický prvek ze skupiny kovů se symbolem Al, který byl objeven v roce 1825. Je to pevná, stříbřitě bílá, modře zabarvená, tvárná a tvárná látka. Je to jeden z nejlepších vodičů elektřiny a tepla. Hliník je skvělý pro svařování, lepení, nýtování, odlévání, smaltování, tažení do trubek a tenkých drátů, stejně jako tvarování do velmi tenkých fólií.
Hliník - vlastnosti a použití
Díky svým fyzikálním a chemickým vlastnostem byl hliník široce používán. Oceňují se zejména jeho nízká hustota, dobrá plasticita (i když je čistý krystalický hliník křehký a křehký) a odolnost proti rzi.
Je běžné používat slitiny hliníku s jinými kovy: duralem, letadly, siluminem, zejména ve stavebnictví (snižování hmotnosti ocelových konstrukcí) a automobilovém průmyslu (karoserie, motory, ráfky), při výrobě lodí, letadel (hliník tvoří asi 80% jejich hmotnosti a na rozdíl od oceli nekoroduje) a raketoplány.
Hliník se používá v chemickém průmyslu, při těžbě na výrobu výbušnin, vyrábí se z něj plechovky a tenké fólie pro balení potravin.
V medicíně se používají sloučeniny hliníku - hydroxid hlinitý při hyperaciditě a žaludečních vředech a síran hlinitý pro spolehlivé krvácení. Průmyslová odvětví, ve kterých se hliníkové výrobky používají, jsou:
- konstrukce - hliníkové truhlářství, střešní krytiny, fasády, topení, klimatizace, izolace
- komunikace - automobilové komponenty, vozidla, stavba lodí, železnice, infrastruktura
- elektrotechnika - osvětlení, elektrické spotřebiče, antény, zařízení RTV
- výroba strojů - chladicí pulty, klimatizace, nádrže, sušárny, kovové doplňky
- obaly - víčka, jednorázové obaly, podnosy, plechovky, fólie
- Domácí spotřebiče - pánve, konvice, hrnce, chladničky, digestoře
Hliník - dopad na zdraví. Je hliník škodlivý?
Hliník se v lidském těle hromadí s věkem. V tělech novorozenců je to v průměru 0,2 mg / kg tělesné hmotnosti, zatímco u starších osob - 0,6-0,7 mg / kg tělesné hmotnosti.
Dospělý organismus hromadí 50 až 150 mg hliníku, z toho 50% v plicích, 25% v kostech a kloubech a zbývajících 25% v měkkých tkáních. Hliník se hromadí v tkáních, protože jeho ionty Al3 + jsou svou velikostí velmi podobné iontům železa Fe3 +, a proto mohou nahradit železo v různých proteinech nebo enzymech.
Po průchodu sliznicí je hliník zabudován do proteinu transferinu (transportujícího ionty železa), který je absorbován každou buňkou v těle. Uvnitř buněk transferrin uvolňuje vázaný iont a vrací se do oběhu. Takto hliník vstupuje do mozku, plic, kostí a dalších tkání.
Hliník je prvek, který je toxický pro lidské tělo. Tento vztah je zvláště patrný u pacientů na dialýze, protože zařízení používané k dialýze neodstraňuje ionty hliníku z plazmy tak účinně jako ledviny.
Lidé na dialýze trpí zhoršenou koordinací pohybů, třesem svalů, nedobrovolnými pohyby nebo demencí, ke které dochází i 15 měsíců po zahájení dialýzy. Toxické účinky hliníku ovlivňují hlavně nervový, kosterní a krevní systém.
Mezi hlavní příznaky otravy hliníkem patří:
- oslabené intelektuální funkce
- zapomnětlivost
- problémy s koncentrací
- poruchy řeči
- změny osobnosti
- proměnlivá nálada
- Deprese
- demence
- vizuální a sluchové halucinace
- osteomalace a častější zlomeniny kostí
- motorické poruchy
- slabost, únava
- anémie
- záchvaty
Hliník prochází hematoencefalickou bariérou a hromadí se zejména v hipokampu. To je zodpovědné za stavy, jako je amyotrofická laterální skleróza, senilní demence, Parkinsonova choroba a do určité míry Alzheimerova choroba.
Koncentrace iontů hliníku v mozku starších lidí, kteří umírají na neurodegenerativní onemocnění, je vyšší než u těch, kteří zemřeli z jiných příčin. Epidemiologické studie navíc ukazují přímo úměrný vztah mezi obsahem hliníku v životním prostředí a počtem lidí trpících senilní demencí.
Hliník - zdroje v potravinách a další
Rostlinné potraviny jsou důležitým zdrojem hliníku ve stravě. Tento prvek se hromadí v zelenině, ovoci a obilí. Rostliny jej shromažďují hlavně z půdy kořeny, ale také ze srážek a atmosférického prachu. Určité množství hliníku je nezbytné pro růst rostlin.
Koncentrace hliníku významně závisí na prostředí, druhu, rostlinné části a stadiu vývoje. Čím starší a zralejší rostlina, tím vyšší je koncentrace hliníku v jejích tkáních. Většina rostlin akumuluje méně než 25 μg hliníku na gram hmotnosti suchého produktu.
Luštěniny (fazole, hrách, sója, čočka, cizrna), koření jako tymián a majoránka hromadí velké množství hliníku a jeho hlavním zdrojem ve stravě je čaj, který roste na kyselých půdách a hromadí se v listech od 500 do 20 000 ppm hliníku . Většina hliníku v čaji je však ve formě ve vodě nerozpustné soli a do varu se přidává malé množství 2 až 6 mg / l.
Přenos iontů hliníku do infuze se zvyšuje, když se pH roztoku sníží přidáním citronu nebo kyseliny citronové. Poté kyselina reaguje se solemi hliníku a ionty kovů migrují. V živočišných produktech je obsah hliníku velmi nízký, nejčastěji pod 1 μg / g suché hmotnosti.
Výjimkou je švýcarský sýr (19 μg / g DM). Množství hliníku lze také zvýšit v mléce a mléčných výrobcích, což souvisí se skladováním mléka v hliníkových nádržích během výrobního procesu.
Výše tohoto prvku může vzbuzovat obavy související se zdravotním rizikem. Při nákupu mléka je lepší zvolit si ty, které jsou v plastových obalech než lepenka potažená vrstvou hliníkové fólie. Doporučuje se také používat ocelové nádrže v mlékárnách místo hliníkových.
Je však třeba poznamenat, že sloučeniny fosforu přítomné v mléce snižují absorpci hliníku. Díky zvýšenému obsahu hliníku v povrchových vodách se zvyšuje také akumulace v rybách a mořských plodech.
Zdrojem hliníku, který se hromadí v lidském těle, je nejen jídlo. Je součástí výrobků každodenní hygieny a některých léků. Vzhledem k jeho velmi široké distribuci v přírodě je nemožné úplně se vyhnout hliníku. Tento prvek je dodáván do těla prostřednictvím:
- čajové nálevy (2 - 6 mg / l)
- káva (0,8 - 1,2 mg / sklenice)
- pitná voda (0,07 mg / l)
- nápoje v hliníkových plechovkách (0,04 - 1,0 mg / l)
- vařený špenát (25 mg / kg)
- nezpracované jídlo (0,1 - 7 mg / kg)
- potravinářské přídatné látky (10-20 mg / den)
- jídlo vařené v hliníkových nádobách (0,2 - 125 mg / kg)
- sojové náhražky mléka (6 - 11 mg / kg)
- antacida (35 - 200 mg / dávka)
- aspirin (9 - 50 mg / dávka)
- léky proti průjmu (36 - 1450 mg / dávka)
- antiperspiranty (50 - 75 mg / den)
- vakcíny (0,15 - 0,85 mg / dávka)
Hliník - potravinářské přídatné látky obsahující hliník
Přísady obsahující hliník schválené pro použití v potravinách jsou:
- E 520 - síran hlinitý, pojivo
- E 521 - síran sodný - hlinitý, regulátor kyselosti, pojivo
- E 522 - síran hlinito-draselný, regulátor kyselosti, pojivo
- E 523 - síran amonno-hlinitý, regulátor kyselosti
- E 541 (I, II) - fosforečnany sodno-hlinité (kyselé a zásadité), kypřící látka
- E 554 - hlinitokřemičitan sodný, protispékavá látka
- E 555 - křemičitan draselno-hlinitý, protihrudkující látka, nosič
- E 556 - hlinitokřemičitan vápenatý, protihrudkující látka
- E 559 - křemičitan hlinitý, prostředek proti spékání, nosič
Sloučeniny hliníku se používají v kandovaném, křišťálovém a matném ovoci, sušenkách, směsích koření, strouhaných sýrech, krájených sýrech, cukrovinkách kromě čokolády, žvýkaček, uzenin, sušených a práškových potravin.
Odhadovaná spotřeba potravinářských přídatných látek obsahujících hliník se v Evropě pohybuje od 2,3 do 145,9 mg / kg tělesné hmotnosti / týden v závislosti na zemi a věkové skupině. Jejich nejvyšší spotřeba je pozorována u dětí.
Jsou hliníkové hrnce škodlivé? Je hliníková fólie zdravá?
Hliník vstupuje do lidského těla hlavně zažívacím traktem, vodou, potravinami, léky a v důsledku používání hliníkových obalů a nádobí. Pronikání hliníku do potravin závisí na typu hliníku, ze kterého je obal nebo nádoba vyrobena, stupni kyselosti potravin, době kontaktu s potravinami a přítomnosti soli. Čím nižší je pH jídla a čím delší je doba vaření nebo skladování, tím více hliníkových iontů do jídla proniká.
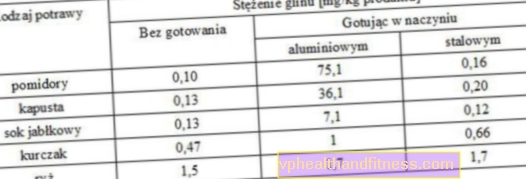
Migrace hliníku z hliníkových nádob do potravin

Světová zdravotnická organizace (WHO) stanovila bezpečný denní příjem hliníku 1 mg / kg tělesné hmotnosti, což znamená, že průměrný člověk vážící 70 kg může bezpečně dostat 70 mg hliníku do těla denně. Aby nedošlo k překročení doporučené dávky, je nutné během vaření používat vhodné nádobí a vyhnout se konzumaci produktů dlouhodobě skladovaných v kovových obalech.
Vaření v hliníkových hrncích, pečení v hliníkové fólii nebo grilování v hliníkových plechech přispívají ke zvýšení množství tohoto prvku ve stravě a mohou být zdraví škodlivé. Zvláště byste měli věnovat pozornost kyselým produktům skladovaným v plechovkách, např. Ryby v rajčatové omáčce, cole a jídle s nízkým pH, jako jsou jablka, hrušky, borůvky, rybíz, maliny, třešně, hrozny, grapefruity, řepa v octě, kečup, citron, citronová šťáva, broskve, nektarinky, ananas, švestky, granátové jablko, rebarbora, kysané zelí, jahody, rajčata a rajčatové konzervy, ocet, ovocné šťávy, suché víno.
Kromě toho byste neměli kyselou zeleninu a ovoce balit do hliníkové fólie, protože pak se hliníkové soli rozpustí a proniknou do jídla. Je také lepší vyhnout se nápojům a potravinám v hliníkových plechovkách, protože je lze skladovat po velmi dlouhou dobu a čas podporuje zvýšenou akumulaci hliníku v nápojích a potravinách. Obsah hliníku v nápojích z hliníkových plechovek je 5 až 7krát vyšší než u stejných nápojů z plastových lahví.
Z hlediska chemikálií je hliník prvkem ve 13. skupině periodické tabulky, který se obvykle nachází v chemických sloučeninách v +3 oxidačním stavu. Tento kov je ve vzduchu pokryt tenkou vrstvou oxidu hlinitého (pasivuje se), což brání další oxidaci a korozi. Vrstva pokrývající kov je odolná proti vodě a slabým kyselinám, ale je zničena silnými kyselinami a zásadami. Oxid hlinitý a hydroxid hlinitý jsou amfoterní sloučeniny - mohou reagovat s kyselými i alkalickými látkami.
Hliník je jednou z hlavních složek zemské kůry (7–8%) po kyslíku a křemíku. Ve volném stavu neexistuje, protože je velmi reaktivní a jeho sloučeniny jsou přítomny téměř ve všech horninách, vodách a živých organismech. Většina sloučenin hliníku v přírodě jsou mírně rozpustné látky, ale některé vykazují toxické vlastnosti pro organismy.
Toxické sloučeniny se uvolňují z neškodných látek v kyselém prostředí, proto proces okyselování půd zvyšuje koncentraci škodlivých forem hliníku v přírodě - v půdách a povrchových vodách. Ve vzduchu je přítomen hliník ve formě prachu. Je také akumulován rostlinami z půdy, srážek a vzduchu. V organismech zvířat se vyskytuje ve stopových množstvích.
Oxid hlinitý v průmyslovém měřítku se získává elektrolýzou oxidu hlinitého, zatímco tento se získává z bauxitu pomocí německé alkalické metody Bayer nebo polské metody Bretsznajderovy kyseliny. Obsah čistého hliníku v bauxitech je vysoký a činí 20–30%. Největšími producenty bauxitu na světě jsou Austrálie, Čína a Brazílie. Ročně se získá celkem asi 60 milionů tun oxidu hlinitého, zatímco čistý primární hliník - asi 25 milionů tun.
Výrobky vyrobené z hliníku se často recyklují, což prodlužuje životní cyklus suroviny. Tento materiál je relativně snadno recyklovatelný, a proto se mu říká „zelený kov“. Ročně se z odděleného sběru odpadu získá přibližně 15 milionů tun hliníku.
Prameny:
1. Zuziak J. et al., Environmentální hliník a jeho vliv na živé organismy, Analit, 2016, 2, 110-120
2. Crisponi G. a kol., Význam expozice hliníku na lidské zdraví a nemoci související s hliníkem, Biomolekulární koncepty, 2013, 4 (1), 77-87
3. Michalski B., Vratislavská univerzita, trh s hliníkem, https://www.ism.uni.wroc.pl/sites/ism/art/michalski_rynek_aluminium.pdf
4. Kossakowski P., Hliník - ekologický materiál, Przegląd Budowlany, 2013, 10, 36-41
5. https://www.clemson.edu/extension/food/food2market/documents/ph_of_common_foods.pdf
6. https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/sp.efsa.2013.EN-411

Přečtěte si více článků od tohoto autora









-tourettea-u-dzieci-i-dorosych---objawy.jpg)









-w-wydychanym-powietrzu.jpg)




